レッドコンプレックス
Periodontal Treatmentby Blue Radical

- レッドコンプレックス
と呼ばれる
極悪歯周病菌3菌種 -
歯周病に関与する細菌の中には、特に強い病原性を持つ「悪性度の高い菌種」が存在します。
1998年、Socranskyは歯肉縁下(歯周ポケット内)のバイオフィルム(歯垢=プラーク)の細菌叢を病原性の違いによってピラミッド型に3層/6つのグループに分類しました。
この「歯周病菌ピラミッド」には上下関係があり、上層・中層・下層の3層に分かれていて、下層ほど病原性が低く、上層ほど病原性が高いとされており、最上層に分類されたのが血液の色が由来の「レッドコンプレックス」です。
歯周病菌ピラミッド
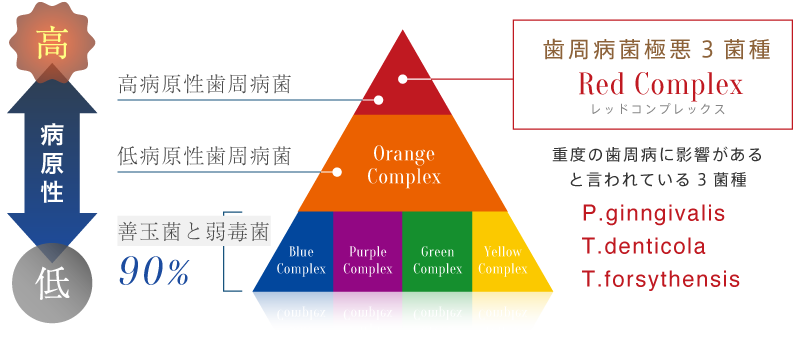
レッドコンプレックスには、ポルフィロモナス・ジンジバリス(Porphyromonas gingivalis:P.g.菌)、トレポネーマ・デンティコーラ(Treponema denticola:T.d.菌)、タンネレラ・フォーサイセンシス(Tannerella forsythensis:T.f.菌)の3菌種が含まれます。これらは、歯周病患者の歯周ポケットから高頻度で同時に検出されることが多く、互いに栄養や環境を補い合いながら共生することで、より強い病原性を発揮することが明らかにされています。
なかでもP.g.菌は、レッドコンプレックスの中でも最も病原性が高く、「歯周病菌ピラミッドの頂点に位置する菌」とされています。さらに、P.g.菌にはいくつかの遺伝的型が存在し、その中でもⅡ型のP.g.菌が最も強い病原性を持つと報告されています。
歯肉縁を境に異なる、
バイオフィルムの細菌叢
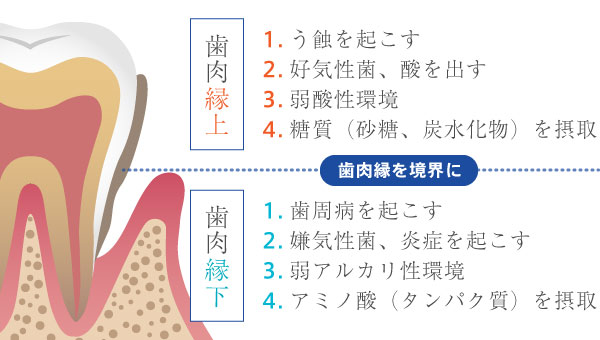
歯肉縁とは2つの異なった細菌叢を隔てる境界です。虫歯菌は歯肉縁上、歯周病菌は歯肉縁下(歯周ポケット内)に棲んでいます。
この歯肉縁を境に、歯肉縁上と歯肉縁下のバイオフィルム(歯垢=プラーク)に棲む細菌は全く異なる性質を持っています。
歯肉縁上に存在するバイオフィルムには、主にう蝕(虫歯)の原因となる好気性(酸素を好む)細菌が多く、酸性環境や糖質(砂糖・炭水化物)を好みます。一方、歯肉縁下に生息する細菌群は、嫌気性(酸素を嫌う)でアルカリ性環境を好み、タンパク質由来のアミノ酸を栄養源とするのが特徴です。さらに、これら両方の性質を併せ持ち、病原性の低い中間型の細菌も存在します。
バイオフィルムの高病原化
(Microbial Shift)
口腔内の細菌叢は、宿主と共存しながらバランスを保っており、これを「安定した菌叢(Symbiosis)」と呼びます。しかし、バイオフィルム(歯垢=プラーク)内の環境が変化すると、病原性が高い状態「不安定な菌叢(Dysbiosis)」へと変わることがあります。このような細菌叢の変化を「マイクロバイアル・シフト(Microbial Shift)」といいます。
バイオフィルムの病原性が高くなるのは、新たな細菌種が参入するのではなく、バイオフィルム周囲の環境変化(栄養・温度・pH・嫌気度など)で細菌が活性を高めるためです。
このとき中心的な役割を果たすのが、ポルフィロモナス・ジンジバリス(Porphyromonas gingivalis:P.g.菌)です。P.g.菌は「キーストーン・パソジェン(Keystone Pathogen=要となる病原菌)」と呼ばれ、微量であっても周囲の善玉菌や日和見菌を“病原菌化”させ、全体の病原性を押し上げる力を持っています。
ポルフィロモナス・ジンジバリス
(P.g.菌)が最恐の理由
- Keystone pasthogen
(要となる病原菌) - 本来なら無害の歯周病菌ピラミッドの最下層の日和見菌がポルフィロモナス・ジンジバリス(Porphyromonas gingivalis:P.g.菌)がいると悪さをするようになり、バイオフィルムの病原性が高まり、歯周病を引き起こすようになる。
- タンパク質分解酵素
- ジンジパインという強力なタンパク質分解酵素を分泌してどんなタンパク質でも苦も無く分解(消化)できるジンジパインはアミロイドβの蓄積を促す認知症の原因のひとつ。
- 毒素を合成
- 毒性のある揮発性硫黄化合物を合成して白血球などの免疫から身を守る。
- 出血するほど強力に
- 血液中の鉄や血清を食べてさらに力を増す。
- しぶとい
- 歯周病治療でバイオフィルムを破壊しても、舌の表面やお口の粘膜に逃げ込んでしぶとく生き残る。
- 微少な悪玉菌が引き起こす
全体の病原化 -
バイオフィルム内の細菌のうち、実際に悪玉菌(高病原性菌)と呼ばれるのは10%程度であり、残りの約90%はもともと無害な常在菌や日和見菌です。しかし、P.g.菌をはじめとするレッドコンプレックスや中間層のオレンジコンプレックスの一部の菌が主導することで、この大多数の菌たちまでもが病原性を帯びた集団へと変化していくのです。
このように、少数の病原菌が、善玉菌を“味方”につけて起こすのがMicrobial Shiftであり、歯周病発症のメカニズムの核心部分となっています。
歯周病発症のきっかけ
歯周病菌の感染を受けても歯周病の症状が出ない人もおり、重症度は患者さんごとに大きく異なることから、歯周組織の抵抗力が歯周病の発症・進行を左右する因子であるとされていました。
しかしレッドコンプレックスの存在が明らかになったことで、バイオフィルムの高病原化(Microbial Shift)が歯周病発症・進行のきっかけと突き止められました。バイオフィルムの病原性が高まり、歯周組織の防御機構とのバランス(恒常性)が破綻したときに、歯周病は発症・進行します。
この破綻には、以下の2つの因子が大きく関与しています。
- 1.バイオフィルム側の高病原化(Microbial Shift)
- 2.歯周組織側の抵抗性の低下(加齢、ストレス、全身疾患、遺伝など)
バイオフィルムの高病原化(Microbial shift)の最大の原因は「出血(歯肉出血)」です。歯周ポケットからの出血によって、タンパク質と鉄分が豊富に供給されると、P.g.菌などの嫌気性・蛋白質分解型の細菌が活性化し、Dysbiosisが進行します。
- 歯周組織の
抵抗性 -
- 免疫能の低下
- 唾液中の
抗菌因子の低下 - 喫煙
- ストレス/疲労
- 不十分な
ブラッシング
- バイオフィルムの
高病原性化 -
- 異なる菌種間の付着
(凝集) - 代謝物質による相互作用
- 細菌間同士の
物質産生制御 - ポケット内出血からの
タンパク質供給 - ヘモグロビンからの
鉄分供給 - ポケット内の嫌気化
- 喫煙による
バイオフィルム硬化
- 異なる菌種間の付着
歯周病菌ピラミッドと歯周病菌
歯周病菌ピラミッドは幼い頃から長い時間をかけていろいろな菌種が感染することによって積み上げられていきます。下層から順番に積み上げられないと歯周病菌ピラミッドは完成しません。
歯周病菌ピラミッドは年齢を重ねるごとに階層が増えていきます。ピラミッドの最下層は善玉菌と弱毒菌からなり、小学生の頃に感染します。そして、中層の低病原性歯周病菌は中学生の頃に感染します。最後に、最上層のレッドコンプレックスと呼ばれる高病原性歯周病菌が18歳以降に感染してピラミッドは完成します。
ピラミッドの頂点(レッドコンプレックス)には、P.ginngivallis(P.g.菌)が棲みついており、最も高い歯周病原性を持っています。
年齢とともにピラミッドの階層が増えていく!
-

ローリスク
-

ミドルリスク
“不潔性歯周炎” -

ハイリスク
“感染性歯周炎”
歯周病菌ピラミッドの感染を阻止するためには、小・中学生の頃から歯磨きを徹底させ、食習慣・生活習慣を正して、さらに人からの感染を予防することが重要です。
また、口腔管理が徹底されている子供はP.ginngivallisが口腔内に入ってきても定着しにくく、歯周病菌ピラミッドの完成が阻害されると考えられています。
子供のころからの口腔管理は虫歯(子供に多発)だけでなく、歯周病(成人に多い)の予防にも大切なのです。
病原性の高い歯周病の見つけ方
- レッドコンプレックス、特に
ポルフィロモナス・ジンジバリス(P.g.菌)がいるかいないか
を調べることにより、病原性の高い歯周病かどうかを判定できる! -
Porphyrins gingivalis(ポルフィロモナス・ジンジバリス:P.g.菌)を頂点とするレッドコンプレックス3菌種がいるかいないかを、位相差顕微鏡検査や遺伝子検査で調べることで病原性の高い歯周炎かどうかを判定できるようになりました。
これまでは、培養による細菌検査だったのが歯周病菌のDNAを検出する画期的な方法が開発されて高感度で歯周病菌の検出が行えます。
1980年代は、P.g.菌/T.d.菌/T.f.菌のレッドコンプレックス3菌種に加えて、Prevotella intermedia、Fusobacterium nucleatum、Aggregatibacter actinomrcetemcomitansなど10種類の嫌気性菌種が歯周病原性菌と呼ばれていました。
しかし、歯周病菌の検出の精度がより高くなったことにより、ピラミッド型の病原性による上下関係がはっきりしてレッドコンプレックス以外の菌種への評価は変わってしまい、“歯周菌”でも“歯周病原性菌”でもなく、“歯周病関連菌”と呼ばれるようになりました。
歯周病の病因論の変遷
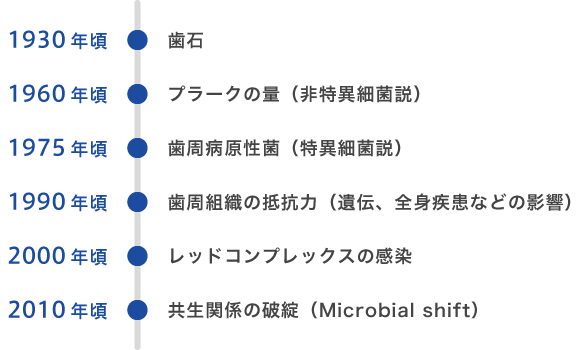
- 時代と共に歯周病の病因論は
変遷してきました! -
約100年前まで、歯周病の原因は「歯石」とされていました。
しかし、歯石自体には病原性がないことがわかり1960年頃には「バイオフィルム(歯垢=プラーク)」が問題視されるようになりました。
当時は、細菌の種類を詳細に調べる技術がなかったため、「プラークの量」が原因とされ、徹底的な歯ブラシが推奨されていました。
1975年頃になると、嫌気培養(酸素を嫌う細菌を育てる方法)の技術が進歩し、重度の歯周病患者の歯周ポケットから、10種類以上の嫌気性菌が高頻度に検出されたことから、これらが歯周病と関連していると考えられるようになりました。
さらに研究が進む中で、プラーク内には「善玉菌」と「悪玉菌」が共存し、人によって病原性(発症リスク)が異なることもわかってきました。
ただし当時は、本当に歯周病を「発症」させるかまでは明確ではなかったため、“歯周菌”と断定されず、“歯周病原性菌”あるいは“歯周病関連菌”と呼ばれていました。
そして1990年頃には、細菌のDNA(遺伝子)を直接検出する検査法が開発されます。この技術革新により、従来の培養法と比べて格段に高い感度で、レッドコンプレックスを含む歯周病菌の正確な検出が可能になりました。
こうして見えてきた“病原菌の質”、その中でもレッドコンプレックスの存在が歯周病を治療する上で重要視されるようになりました。
歯周病の発症を予防するために
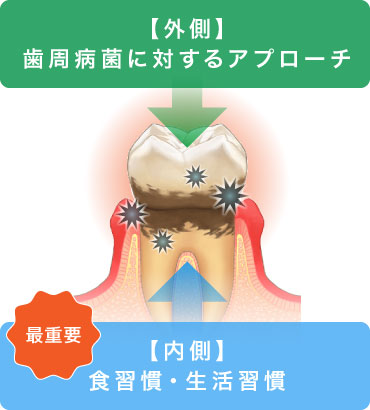
レッドコンプレックス、特にポルフィロモナス・ジンジバリス(Porphyromonas gingivalis:P.g.菌)は、歯周病の発症・進行に深く関わってきます。しかし、P.g.菌の病原性は条件によって大きく変わることが知られています。例えば、P.g.菌の増殖と病原性には、赤血球中のヘモグロビンに含まれる“ヘミン鉄”が必須です。この鉄が供給されない環境下では、P.g.菌は活性を維持できず、高病原化(Microbial shift)を起こすことができません(低病原性)。
P.g.菌は誰の口の中にでもいる常在菌です。つまり、P.g.菌に感染している=歯周病になる、というわけではありません。生涯にわたって発症しない不顕性感染のままの人もいます。
したがって、歯周病は予防できるということです。予防には歯周病菌の病原性を下げる(外側からのアプローチ)と、免疫からの攻撃・低栄養を避け、歯周組織の抵抗力を高める食生活・生活習慣(内側からのアプローチ)の両立が大切です。
レッドコンプレックス3菌種の
感染の有無・程度を精密検査
歯周病は、細菌による感染症です。
つまり、的確な治療には細菌の状態を
詳細に把握することが必要です。
治療の必要性・治療の評価を確認
当院で行う歯周病菌の検査
-
肉眼レベル:歯垢(プラーク)の付着量(細菌の量)を把握する
-
顕微鏡レベル:歯周病原因菌の種類や活動性(細菌の質)を観察する
-
遺伝子レベル:特定の歯周病菌の有無と数を正確に測定する
中でも、特に病原性が高い「レッドコンプレックス3菌種」については、遺伝子検査により感染の有無や程度を詳しく調べることができます。
-
臭気レベル:歯周病由来の口臭の原因ガスを分析する
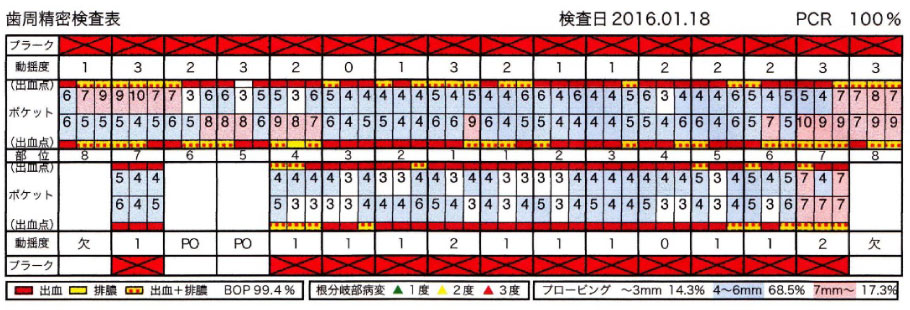
- 歯周組織精密検査の重要性
- まず、歯周病の進行度を多角的かつ精密に検査します。具体的には、磨き残し(プラーク付着率)《%》、歯周ポケット(歯と歯肉の境にある溝)の深さ《mm》、歯周ポケット測定後の出血、排膿の有無、歯の動揺度(どのくらいグラグラするか)《0~3》を調べます。
肉眼レベル(細菌の量)の検査
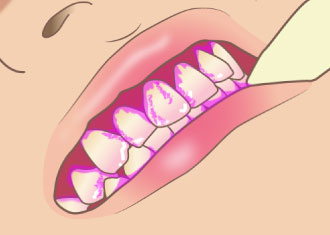
プラーク(歯垢)を専用の染色液で染め出して、磨き残しの有無を可視化します。
歯周組織精密検査の中に
磨き残しの検査が含まれています。
プラークの付着率が「%」で表されます。
顕微鏡レベル(細菌の質)の検査
トレポネーマ・デンティコーラ(Treponema denticola:T.d.菌)を検査します。
肉眼では確認できないため位相差顕微鏡を用いて、歯周病の原因となる細菌の種類や活動の様子、治療による変化を視覚的に確認することができます。
- スピロヘーター
(らせん菌)の著しい減少 -
-
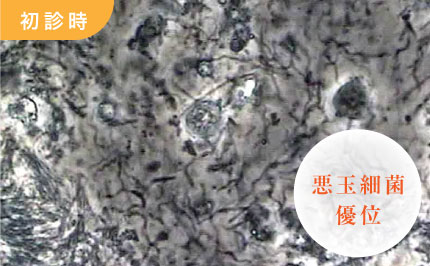
スピロヘーター(らせん菌)、運動性の桿菌などの悪玉細菌が多く観察できます。
-

約3週間
-
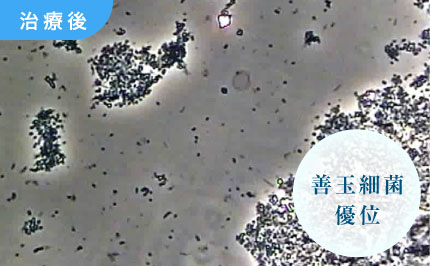
悪玉細菌が消え、殆どが日和見菌、善玉細菌となりました。
-
遺伝子レベル
(細菌の種類と量)の検査

ポルフィロモナス・ジンジバリス(Porphyromonas gingivalis:P.g.菌)、タンネレラ・フォーサイセンシス(Tannerella forsythensis:T.f.菌)は小さい桿菌で、顕微鏡では確認できないため、リアルタイムPCR法を用いた遺伝子検査を行います。
この検査では「どの菌が存在するか」「それぞれの菌がどれだけ存在するか」を正確な数値で把握し、精密な診断と適切な治療計画の立案が可能になります。
※ PCR法(Polymerase Chain Reaction):DNAの一部を増幅させ検査します。
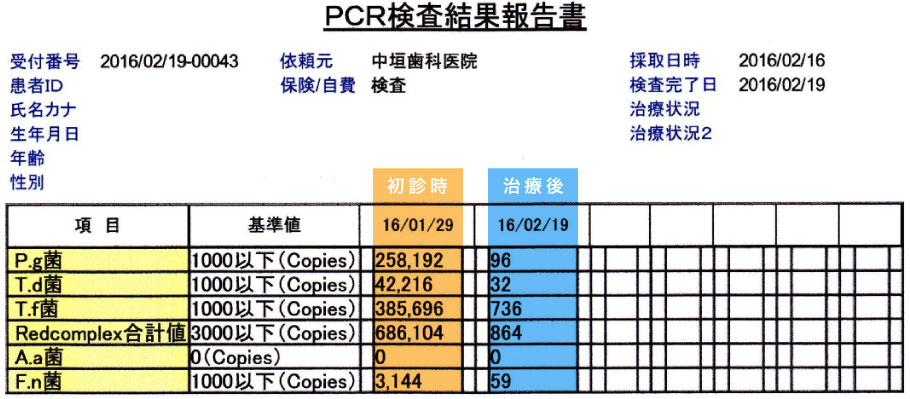
- レッドコンプレックスの3菌種を含む
歯周病菌極悪5菌種のうち、A.a菌を除き
4菌種が基準値をはるかに超えていました。 - 治療後、問題となる極悪歯周病細菌数が
基準値以内(1000以下)に収まりました。
臭気レベル
(口臭ガスの分析)の検査
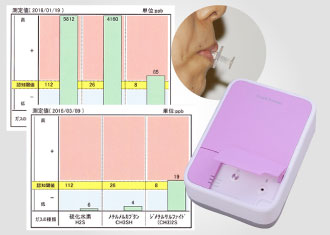
歯周病由来で発生する口臭内の原因物質(ガス)をシリンジで採取し、代表的な3つの口臭ガス(硫化水素/ジメチルメルカプタン/メチルメルカプタン)の濃度を測定します。
この検査結果から、悪玉菌の増殖状況や口内フローラのバランス(善玉菌 vs 悪玉菌)を把握できます。
細菌が産生する口臭ガスである硫化水素と
ジメチルメルカプタンの発生が激減しました